Aturan konfigurasi elektron s p d f atau aturan konfigurasi elektron pada teori atom mekanika kuantum mengikuti 4 aturan. Empat aturan konfigurasi elektron s p d f terdiri dari Prinsip Aufbau, Aturan Hund, larangan Pauli, serta aturan penuh-setengah penuh. Empat aturan tersebut menjelaskan bagaimana cara elektron menempati kedudukan atau posisinya.
Teori atom mekanika kuantum menyatakan bahwa elektron suatu atom menempati orbital yaitu daerah kebolehjadian ditemukan elektron. Jumlah dan bentuk orbital pada setiap sub kulit s, p, d, dan f berbeda-beda. Jumlah orbital pada sub kulit s, p, d, dan f berturut-turut adalah 1, 3, 5, dan 7. Setiap satu orbital dapat memuat paling banyak dua leketron. Sehingga, banyak elektron maksimal yang menempati sub kulit s, p, d, dan f berturut-turut adalah 2, 6, 10, dan 14 elektron.
Bagaimana cara elektron dari suatu atom menempati orbital? Penjelasan mengenai cara pengisian elektron berdasarkan empat aturan adalam teori atom mekanika kuantum dapat disimak melalui ulasan di bawah.
Prinsip Aufbau
Prinsip Aufbau mengatur pengisian elektron akan secara bertahap menempati suatu orbital dimulai dari sub kulit dengan tingkat energi paling rendah. Kondisi ini sesuai dengan kata Aufbau (dalam bahasa Jerman) yang bermakna meningkat. Dengan kata lain, pengisian elektron berawal dari sub kulit dengan tingkat energi paling rendah meningkat ke sub kulit dengan energi yang lebih tinggi.
Pengisian elektron akan beralih ke sub kulit berikutnya setelah orbital sub kulit berenergi rendah terisi penuh. Pengisian elektron terjadi begitu seterusnya sampai semua elektron dalam atom menempati orbitalnya.
Berikut adalah gambar urutan tingkat energi untuk pengisian elektron berdasarkan Aturan Aufbau.
Baca Juga: Cara Mengetahui Jumlah Proton, Nutron, dan Elektron dari Suatu Atom
Aturan Hund
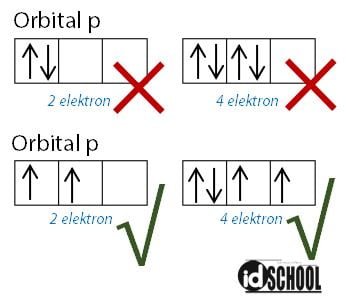
Aturan Hund digunakan pada saat elektron-elektron menempati orbital-orbital pada setiap sub kulit. Kaidah ini pertama kali dikemukakan oleh Friedrich Hund yang merupakan seorang ahli kimia Jerman. Menurut kaidah Hund, pengisian elektron tidak akan berpasangan sebelum orbital-orbital dalam satu sub kulit sudah terisi oleh masing-masing 1 elektron.
Elektron akan menempati orbital dengan arah yang sama terlebih dahulu. Setelah orbital dalam sub kulit terpenuhi oleh elektron dengan arah yang sama kemudian elektron akan mengisi orbital dengan arah berlawanan. Sehingga, sebuah orbital akan terisi penuh oleh dua elektron dengan arah yang berlawanan.
Arah elektron yang menempati orbital dijelaskan dalam bilangan kuantum spin. Arah putaran elektron yang searah jarum jam memiliki nilai s = +1, dengan simbol tanda panah ke atas. Sedangkan arah putaran elektron yang berlawanan arah jarum jam memiliki nilai s = -1 (simbol tanda panah ke bawah).
Perhatikan contoh pengisian elektron pada sub kulit yang benar dan contoh yang salah berikut.
Baca Juga: Sifat Atom Berdasarkan Urutannya dalam Tabel Periodik Unsur
Larangan Pauli
Larangan Pauli pertama kali disampaikan Wolfgang Pauli bahwa dalam suatu sistem (baik atom maupun molekul) tidak ada dua elektron yang mempunyai empat bilangan kuantum yang sama. Atau, dapat dikatakan bahwa setiap elektron dari suatu atom atau molekul selalu memiliki empat bilangan kuantum yang berbeda.
Bilangan kuantum adalah bilangan yang menyatakan kedudukan/posisi elektron dalam suatu nilai. Ada empat bilangan kuantum yang digunakan untuk menyatakan kedudukan elektron. Keempat bilangan kuantum tersebut meliputi bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
Elektron-elektron pada suatu atom akan selalu memiliki nilai bilangan kuantum yang berbeda. Kondisi ini terjadi karena setiap orbital hanya dapat ditempati oleh dua elektron. Apabila ada 2 elektron yang menempati orbital yang sama, artinya mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama. Namun kedua elektron memiliki bilangan kuantum spin yang berbeda.
Aturan Penuh dan Setengah Penuh
Aturan penuh-setengah penuh terjadi pada atom dengan golongan B yaitu pada pengisian elektron pada subkulit d. Elektron yang berisi penuh d10 dan setengah penuh d5 akan relatif lebih stabil. Sehingga, elektron cenderung akan mengisi orbital secara penuh atau setengah penuh.
Sebagai contoh konfigurasi atom 24Cr akan relatif lebih stabil dengan konfigurasi elektron [Ar] 4s1, 3d5 dari pada konfigurasi elektron [Ar] 4s2 3d4.
Demikianlah tadi ulasan 4 aturan konfigurasi elektron pada teori atom mekanika kuantum. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Konfigurasi Elektron pada Model Bohr dan Mekanika Kuantum
Sumber gini.com



EmoticonEmoticon